Asiantuntijavastine suomalaisten endokrinologien lausuntoihin
Professori, LT, sisätautilääkäri ja endokrinologi Rudolf Hoermann on eläköitynyt virastaan Bonnin yliopiston alaisen Lüdenscheidin suuren opetussairaalan yleislääketieteen, gastroenterologian ja endokrinologian osaston ylilääkärin virasta.
Dr. Hoermann on kirjoittanut tai ollut mukana kirjoittamassa yli sataa artikkelia tai katsausartikkelia kansainvälisissä lääketieteen aikakauslehdissä.
Hänen viimeaikaiset työnsä osoittavat vahvaa kiinnostusta henkilökohtaisesti räätälöityyn lääkintään, ja ne sisältävät sarjan artikkeleita kilpirauhastoiminnan säätelystä vertaisarvioiduissa kansainvälisissä tiedelehdissä, jotka ovat eniten luettuja alallaan.
Professori Hoermann on ystävällisesti kommentoinut eräitä suomalaisten endokrinologien lausumia.
***
Lihavoitu teksti on suomalaisten kirjoittamaa, normaali on professori Hoermannin tekstiä.
***
1. Suomen endokrinologiyhdistyksen lausunto 2014
Väite: "S-T3v ei ole tarpeen vajaatoiminnan diagnostiikassa."
Vastaus: T-3V:n mittaus on diagnostisesti käyttökelpoinen ja se auttaa löytämään ne potilaat, joilla on heikentynyt kyky muuntaa T4 -hormonia T3-hormoniksi.
Tämän valvominen on tärkeää, koska tyroksiinihoidon biokemiallinen vaste on osoittautunut erittäin vaihtelevaksi (Midgley et al. 2015). Muunnon tehokkuus on yleisesti ottaen usein häiriintynyt tyroksiinihoidolla olevilla potilailla, erityisesti heillä, joilta puuttuu kilpirauhanen leikkauksen jälkeen, verrattuna terveeseen populaatioon tai saman henkilön leikkausta edeltäviin laboratorioarvoihin (Gullo et al. 2012, Ito et al. 2012, Hoermann et al. 2014).
On tärkeää huomata, että TSH ja biologisesti aktiivinen T-3V eriytyvät tyroksiinihoidolla (Midgley et al. 2015, Hoermann et al. 2016). Tällä dramaattisella muutoksella TSH:n, T-4V:n ja T-3V:n välisessä tasapainossa on tärkeitä seurauksia. Ensinnäkin TSH ei silloin enää voi toimia "eutyreoosin" luotettavana markkerina (Hoermann et al. 2013, 2016, 2017). Toisin sanoen TSH, joka on viitteissä, ei enää takaa, että potilas on "eutyreoottinen" ja kaikki on hyvin. On perustavanlaatuinen virhe luottaa "terveeseen TSH-viitealueeseen" ja jättää huomioimatta muuttunut fysiologinen tila, joka vakiintuu ja muuntuu aivan erilaiseen tasapainotilaan kuin aiemmin terveenä (Gullo et al. 2012, Ito et al. 2017, Hoermann et al. 2015, 2016, 2017).
Tämä voisi selittää ainakin osittain, miksi niin monet potilaat ovat edelleen tyytymättömiä normaaliin tyroksiinihoitoon, kuten on dokumentoitu esimerkiksi, kun on arvioitu heidän elämänlaatuaan. Tanskalaiset kirjoittajat ovat äskettäin tehneet erittäin tarkan tutkimuksen, käyttäen vasta kehitettyä ja validoitua kilpirauhasen kyselylomaketta, ja päätyneet siihen johtopäätökseen, että tyroksiinilla hoidetut potilaat eivät yleensä parane terveen väestön tasolle (Winther et al. 2016).
Tämä tarkoittaa, että on selvästi tarvetta parantaa potilaiden hoitoa. T-3V:n mittaus tuottaa merkittävästi lisätietoa tilanteessa, jossa TSH on riittämätön tietolähde. Muita sairauksia on harkittava, koska ne voivat sekoittaa sen tulkintaa, ja lääkärin pitää koota kaikki tieto yhteen, ei pelkästään yksi koetulos tai laboratorion raportti.
***
Väite: "Käänteis-T3 (reverse T3, rT3) - määrityksestä ei ole apua. rT3 on inaktiivinen kilpirauhasmetaboliitti, jonka pitoisuudet seuraavat T4-pitoisuuksia."
Vastaus: Käänteis-T3 ei ole inaktiivinen metaboliitti, kuten on pitkään ajateltu, vaan pikemminkin se toimii T3:n estäjänä. Koko näkemyksemme epäklassisista hormoneista on dramaattisesti muuttunut viime vuosina, ja niille on nousemassa esille uusia rooleja (Hoermann et al. 2015).
***
Väite: "Myöskään DIO2- geenipolymorfismimäärityksen avulla ei ole mahdollista arvioida höytyisikö potilas Thyroxin-hoidon sijasta trijodityroniinihoidosta (T3-hoito, kauppanimellä Liothyronin ja Thybon)."
Vastaus: Helpompi ja halvempi testi voisi olla yksinkertainen suhdeluku T-3V / T-4V. Tämä suhdeluku on yleisesti virheellinen ja matala tyroksiinilla hoidetuilla potilailla verrattuna terveisiin, ja sillä on seurauksia potilaan oireille (Midgley et al. 2015, Winther et al. 2016, Larisch et al. 2018).
***
Väite: "Subkliininen hypotyreoosi hoidetaan aina, jos S-TSH ≥ 10 mU/L. Lievemmässä subkliinisessä hypotyreoosissa hoitoa puoltavat TPO-va -positiivisuus, potilaan nuori ikä, struuma ja hypotyreoosiin sopivat oireet."
Vastaus: Tämä lausuma on väärä ja vastoin kilpirauhasen fysiologiaa, koska sama TSH voi tarkoittaa hyvin erilaisia asioita eri henkilöille (Hoermann et al. 2017). TSH-arvoa ei voida tulkita yksinään (Hoermann et al. 2016, 2017). Aivolisäkehormoni TSH:ta vaaditaan kilpirauhashormonien pitoisuuksien nostamiseen terveelle tasolle. Potilas ilman TSH:ta on vajaatoimintapotilas, kuten esim. aivolisäkkeen sairauden takia sekundääristä kilpirauhasen vajaatoimintaa sairastavat. Tämä luo riippuvuuden ja keskinäisen suhteen pareina TSH:n ja kilpirauhashormonien välille. Sen vuoksi monimuuttuja- tai parimuuttujaviitealuetta on pidettävä oikeampana kuin TSH:n tilastollista jakaumaa yksinään (Hoermann et al. 2016). Tällaisen skenaarion tulos mahdollistaa sen, että tietyllä TSH-arvolla yksi potilas tuntee itsensä vajaatoimintaiseksi, ja toinen ehkä liikatoimintaiseksi. Tätä sanotaan henkilökohtaiseksi asetusarvoksi tai ehdolliseksi tasaantumispisteeksi. TSH-T-4V-pari vaihtelee paljon vähemmän henkilökohtaisesti ja yksilöt sietävät vaihtelua vähemmän, eikä se sovi yhteen väestön laajan TSH-viitealueen kanssa (Hoermann et al. 2017).
Siksi TSH on hyvin erityinen ja yksilöllinen seurantaparametri, jota ei voida tulkita yksinkertaisesti, kuten mitä tahansa muuta tilastollista parametria tai laboratorioarvoa. TSH ei noudata normaalijakaumaa väestössä, ja se on sidoksissa T-4V:hen ja T-3V:hen. Fysiologisesti asetettu TSH-T4-V-parien jakauma terveellä väestöllä on leijan muotoinen, ja se näyttää aivan erilaiselta kuin perinteinen suorakaiteen muotoinen viitealue (Hoermann et al. 2017). Kilpirauhasen fysiologia ei oikeuta liian yksinkertaistettua TSH:n tulkintaa (Hoermann et al. 2010). Sen vuoksi se kelpaa ainoastaan seulontatestiksi, mutta ei luotettavaksi diagnosointikokeeksi.
***
Väite: "T4-ylläpitoannos on oikea, kun potilas voi hyvin ja S-TSH sekä S-T4v ovat viitealueella. Nyrkkisääntönä pyritään TSH-tasoon noin 1 mU/L."
Vastaus: "Kun potilas voi hyvin" asettaa yleiselle lausumalle huomattavan rajoituksen. Tämä mitätöi sen useammin kuin vahvistaa. Hiljattain julkaistun elämänlaatututkimuksen tanskalaiset kirjoittajat sanovat (Winther et al. 2016) "monet elämänlaadun osatekijät paranivat tyroksiinihoidon kuuden ensimmäisen kuukauden aikana, mutta täyttä toipumista ei saavutettu. Tuloksemme voivat auttaa kliinikoita kertomaan potilaille odotettavista olevista kliinisistä hoitovaikutuksista."
TSH-väite on kumottu ylempänä.
***
Väite: "Eläinperäisiä kilpirauhasuutteita sisältäviä valmisteita (kauppanimillä Armour Thyroid ja Thyroid) ei suositella hypotyreoosin hoitoon."
Vastaus: Eläinperäiset kilpirauhasvalmisteet ovat hyväksyttyjä reseptilääkkeitä Yhdysvalloissa, joten niiden pitäisi olla lääkärien ja potilaiden käytettävissä, jos nämä niin haluavat. Hyväksyttyjä lääkkeitä ei pidä hylätä. Lääkärien ja potilaiden pitäisi saada valita mikä tahansa asianomaisen viranomaisen hyväksymä lääke.
***
Väite: "Synteettistä trijodityroniinia (T3, kauppanimillä Liothyronin ja Thybon) ei pidä yksinään käyttää hypotyreoosin hoitoon, koska hoito johtaa helposti T3-toksikoosiin. Kilpirauhashormonihoidon aikana on aina syytä varmistaa, ettei S-TSH laske < 0.1 mU/l."
Vastaus: T3 ei ole ensisijainen valinta lääkkeeksi, mutta sitä on käytetty kauan, varsinkin silloin, kun tyroksiini on jätetty pois ennen radiojodihoitoa. T3:sta on pitkästi käytännön kokemusta monessa maassa, ja se on edelleen hyväksytty lääke, jolla on hyvä turvallisuushistoria. Tämä varoitus T3:n myrkyllisyydestä näyttää aiheelliselta mutta liioitellulta. On olemassa totuudenmukaisempia raportteja T3:n pitkäaikaiskäytöstä, esim. Leese et al. (2016).
Olemme hoitaneet kilpirauhaspotilaita turvallisesti monen vuoden ajan laskemalla TSH hyvin alas, aiempien kilpirauhassyövän hoitosuositusten mukaisesti. Ne vaativat, että TSH lasketaan jatkuvasti mittaamattoman alas, koska pelättiin TSH:n voivan stimuloida jäljelle jääneitä kehon syöpäsoluja kasvamaan ja edistää syövän uusimista.
TSH:n arvo 0,1 ei tarkoita samaa tyroksiinilla hoidetulle potilaalle kuin terveelle, kuten on selostettu yllä (Hoermann et al. 2017). Siksi tämä on väärä keskiarvoistettu johtopäätös.
Turvallisuustutkimuksissa tyroksiinilla hoidettuja tyreotoksisia potilaita ja luonnollisesti liikatoimintaisia potilaita on tarkasteltava erikseen ja tutkittava erillään. Usein esiintyvät sekaraportit on hylättävä väärinä. Tyreotoksikoosin luokittelussa on huomioitava myös T-3V ja T-4V (Hoermann et al. 2017). Matala TSH itsessään on ristiriitainen, eikä sitä voida riittävästi tulkita, koska mikä tahansa erilaisten kokonaisuuksien tulkinta voi johtaa tilastollisen amalgamaation harhaan, joka myös tunnetaan Simpsonin paradoksina.
***
Väite: "Koska T3:n puoliintumisaika on lyhyt (noin 1 vrk), T3-hoidossa ongelmana on potilaan suuri T3-pitoisuuksien vuorokausivaihtelu."
Vastaus: T-3V:llä on luonnollinen vuorokausirytmi, kuten TSH:lla, mutta ei T-4V:llä (Russell et al. 2008). Siksi se myös vaihtelee luonnostaan enemmän kuin T-4V.
***
Väite: "Yhdistelmähoidon vaarana on liian suuren T3-annoksen aiheuttama tyreotoksikoosi, mikä ilmenee pienenä TSH-pitoisuutena, vaikka aamulla ennen lääkevalmistetta otettu T3v-arvo olisikin normaali."
Vastaus: Vaaraa on tarkastettava ja sitä voidaan seurata mittaamalla kaikki kolme kilpirauhasparametrit: TSH, T4-V ja T-3V (Hoermann et al. 2017, Larisch et al. 2018). Siihen tarvitaan T-3V-mittausta.
Pelkkä TSH on riittämätön. Tietenkin oireita on myös tarvittaessa seurattava annoksen säätelyyn.
2. THL/FinOhta kirjallisuuskatsaus, osa 1, 2015 (Palkoa varten)
Väite: "Yhteenvetona kysymyksen 1 vastaukseksi voidaan todeta, että seerumin T3- tai rT3-mittaukset eivät ole luotettavia osoittamaan kilpirauhasen vajaatoimintaa."
Vastaus: T-3V-mittauksen vahvuus on muunnon puuttumisen havaitseminen, joka on myös tärkeä tunnistaa ja seurata tyroksiinihoidon aikana. Se ei ole sellaisenaan käyttökelpoinen kilpirauhasen vajaatoiminnan diagnosoinnissa. Siihen TSH on herkempi, mutta myös vähemmän spesifinen.
***
Teksti: "Voidaanko synteettistä T3:a käyttää kilpirauhasen vajaatoiminnan yksinomaisena hoitona?
Celin ym. julkaisut ovat ainoat satunnaistetut kaksoissokkotutkimukset, jossa T3-hoitoa on verrattu T4-hoitoon."
Vastaus: Celin tutkimusten lisäksi on olemassa runsaasti kokemusta ja kirjallisuutta radiologian erikoislääkäreiltä, joissa T3:a on käytetty ja käytetään edelleen yleisesti ennen radiojodihoitoa, kun tyroksiini on tauotettu.
Vaikka näissä on dokumentoitu kattavasti T3:n lyhytaikainen käyttö, on myös olemassa raportteja joiden mukaan pitkäaikaiskäytön turvallisuusnäkökohtia ei pidä liioitella ja käyttää pelonlietsontaan (Leese 2016).
3. Palkon lausunto 2015, nyt todettu laittomaksi
Väite: "T3-hoidon tehosta eutyreoottisten potilaiden depression tai ylipainon hoidossa ei ole riittävää tutkimusnäyttöä. Käytettävissä olevissa tutkimuksissa ei ole myöskään riittävästi arvioitu hoidon turvallisuutta ja siedettävyyttä."
Vastaus: On tieteellisesti todistettu, että kilpirauhashormonit ovat farmakologisesti tehokkaita mietoina masennuslääkkeinä. Niitä voidaan hyvin käyttää siihen tarkoitukseen, ja niiden etuna on vähäisemmät haittavaikutukset kuin aidoilla masennuslääkkeillä. Tämä pätee vain lievään masennukseen, ei vakavaan mielisairauteen. Ne ovat turvallisia, jos niitä käytetään oikein, ja lääkärien ja potilaiden tulisi voida päättää niiden käytöstä. Lisäksi niiden tulisi olla potilaiden käytettävissä ja korvattavia kuin mikä tahansa muu hyväksytty lääke. Ne eivät ole yhtään vaarallisempia tai kalliimpia kuin masennuslääkkeet, ja niitä voidaan hyvinkin kokeilla lievissä tapauksissa.
4. Duodecim-lehden katsausartikkeli 1/2016
Väite: "TSH on kilpirauhasalkuisen hypotyreoosin hoidon tärkein seurantaparametri. Sen pitoisuuden tulisi olla nuorilla aikuisilla 1–2,5 mU/l, mutta voi olla tätä suurempi keski-ikäisillä ja iäkkäillä potilailla."
Vastaus: Tämä lausuma on vailla perustaa ja vastoin tieteellistä näyttöä, koska tasapainotila on erilainen tyroksiinihoidolla kuin terveillä (kuten on kerrottu ylempänä). Lisäksi arvot vaihtelevat suuresti henkilöstä toiseen ja sairauden laadusta toiseen, joten keskiarvon käyttäminen on harhaanjohtavaa yksilöiden hoidossa. Kilpirauhasen fysiologia on selostettu ylempänä, ja tilastojen käytön suhteen Simpsonin paradoksi on otettava huomioon ja sitä on vältettävä aina kun esiintyy klusterointia (Hoermann et al. 2017).
***
Väite: "1990-luvulla todettiin kuitenkin, ettei rotilla, joilta oli poistettu kilpirauhanen, saavutettu kaikissa kudoksissa pelkällä T4-hoidolla normaaleja T3- ja T4-pitoisuuksia. Tarvittiin myös T3-hoitoa. Tämän seurauksena käynnistyi useita kliinisiä tutkimuksia, joissa verrattiin pelkällä T4:llä annettua hoitoa T4:n ja T3:n yhdistelmään. Tutkimukset ja niiden meta-analyysit eivät kuitenkaan osoittaneet yhdistelmähoitoa paremmaksi, ja lisäksi siihen todettiin liittyvän tyreotoksikoosin vaara (ns. T3-toksikoosi)."
Vastaus: Ne eivät myöskään osoittaneet yhdistelmähoitoa tehottomaksi tai huonommaksi, ja itse asiassa useimmat potilaat valitsivat mieluummin yhdistelmän, kun heiltä tutkimusten lopussa kysyttiin, minkä hoidon valitsisivat. Miksi potilaat olisivat johdonmukaisesti valinneet yhden hoidon sokkotutkimuksissa? Käypä selitys harkittavaksi ja edelleen tutkittavaksi voisi olla, että yhdistelmähoidolla on täytynyt olla jokin sellainen vaikutus, jota elämänlaatu- ja tilastollinen analyysi ei havainnut.
***
Väite: "Kontrolloituja ja satunnaistettuja tutkimuksia hypotyreoosin hoidon ennustevaikutuksesta ei ole."
Vastaus: Ennustetutkimuksilla on laajasti vaihtelevat lopputulokset, ne puhuvat toisiaan vastaan ja niiden tutkimusjoukoissa voi olla erilaisuutta, kuten on muualla pohdittu ja raportoitu (Hoermann et al. 2017).
***
Väite: "Kilpirauhasalkuisessa hypotyreoosissa tärkein laboratoriokoe T4-hoidon vasteen arvioinnissa on TSH, jonka tulisi olla viitealueella. Sentraalisessa eli aivo- tai aivolisäkeperäisessä hypotyreoosissa TSH:n määrityksen sijasta seurantaparametri on T4-V, jonka tavoitepitoisuuden tulisi olla vähintään viitealueen puoliväli."
Vastaus: T-3V-mittauksen lisääminen ja kaikkien kolme kilpirauhasparametrien mittaaminen tarvitaan, jotta voitaisiin saada täydennys kliiniseen kuvaan ja havaita muunnosprosessin tehokkuus, joka voi vaihdella laajasti ja usein erottaa T-3V-vasteen TSH-vasteesta (Hoermann et al. 2013, Midgley et al. 2015, Ito et al. 2017).
***
Väite: "Suurentunut TSH-pitoisuus ja samanaikainen viitealueella oleva T4-V viittaa huonoon hoitomyöntyvyyteen: näin käy, jos potilas unohtaa useita päiväannoksia ja paikkaa niitä ottamalla ylimääräisiä T4-annoksia juuri ennen laboratoriokokeisiin menoa. Jos potilaan vointi ei ole hyvä, kannattaa ensin varmistaa, että potilas ottaa tyroksiinin säännöllisesti ohjeiden mukaan. T4-hoitotyytymättömyyden syyt ovat useimmiten epäselviä, mutta joillain potilailla kilpirauhassairauden psykologinen taakka, muu psykologinen oireilu, somatisaatio, muu samanaikainen yleissairaus (anemia, tulehdustila, hyperkalsemia, diabetes, B12-vitamiinin puute), kilpirauhasen autoimmuunisairaus itsessään tai muu autoimmuunisairaus voivat olla selittäviä tekijöitä. Näitä tulisikin arvioida mahdollisina oireiden selittäjinä."
Vastaus: Tämä kaikki voi tietenkin joskus tapahtua. Mutta selitys on epätodennäköinen, kun otetaan huomioon laajasti dokumentoitu ero elämänlaatututkimuksissa tyroksiinilla hoidettujen ja terveen väestön välillä. On järkevää tutkia autoimmuunin kilpirauhastulehduksen liitännäissairauksia, mutta yleisesti ottaen syytä ei pidä vierittää potilaalle, kun hoitomenetelmässä on yleisiä puutteita.
***
Väite: "On spekuloitu, että joillain potilailla poikkeava, pienentynyt T3-V:n ja T4-V:n suhde voisi viitata heikentyneeseen ääreiskudosten T3:n tuottoon, joka ei siten riittäisi kompensoimaan kilpirauhasen omaa puuttuvaa T3-eritystä. Tästä ei ole kuitenkaan tieteellisesti osoitettua näyttöä ja ääreiskudosten suoraa T3:n tuottoa ei voida kliinisessä työssä mitata."
Vastaus: Mikäli potilaalta puuttuu kilpirauhanen, mistä sitten T3 tulisi ja miksi matala T-3V ei osoittaisi jotain tuotantoketjun virhettä, kuten eläinkokeet ovat osoittaneet (Escobar-Morreale et al. 1995, McAninch et al. 2015, Werneck de Castro et al. 2015). Kokeellisesti on hyvin dokumentoitu, että T-3V:n nostaminen auttaa (esim. Larisch et al. 2018), ja moni potilas voi vahvistaa, että tämä on totta. Tyroksiinihoidolla seerumin T-3V tulee epästabiiliksi. Itsesäätely, joka vakauttaa terveiden T-3V:n laajalla TSH-alueella, ei enää toimi potilaalla jonka kilpirauhanen puuttuu (Hoermann et al. 2016). On hyvin tärkeä huomata tämä ero kilpirauhaseltaan terveen ja sairaan välillä. Mikä kerran voitiin jättää huomiotta, on nyt vakava huolenaihe.
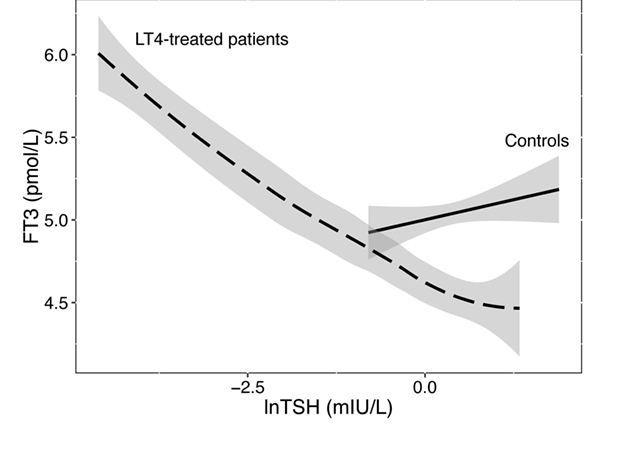
Väite: "Koska T3-V-mittauksien todellinen kliininen merkitys ja tuloksien yhteys T4-hoitotyytymättömyyteen ovat epäselviä, emme tällä hetkellä suosittele perusterveydenhuollon lääkärille T3-V-mitauksien tekemistä T4- hoidon aikana. Lisätutkimuksia asiasta kuitenkin kaivataan erityisesti sellaisilla T4-hoidetuilla potilailla, jotka oireilevat."
Vastaus: Ehkä ei tarvita niinkään uusia tutkimuksia, vaan parempaa tilastollista analyysia. Kilpirauhashormonit ovat erittäin yksilöllisiä, ja tämä on tiedetty Andersen et al.:in pioneerityöstä asti (2002). Tämä on kuitenkin jäänyt huomioimatta tutkimusten tilastollisessa analyysissa. Jokaisen potilaan arvojen liikkuessa omalla käyrällään ja asettuessa hieman eri optimiarvoihin, yksinkertaista keskiarvoistamista ryhmien välillä (kuten hoito- ja verrokkiryhmä) ei voida soveltaa eikä se ole asianmukaista. Vaaditaan kehittyneempien tekniikoiden, kuten monitasoisten mallien käyttöä, missä huomioidaan yksilötason muuttuva tulos.
Tällaista mallia käyttämällä oireiden lievittymisen yhteys T-3V-pitoisuuteen voitiin osoittaa laajassa retrospektiivisessä tutkimuksessa (Larisch et al. 2018). Potilaiden kokemuksista kerätyt oireet esiintyivät todennäköisemmin, kun T3-V oli matala, ja hävisivät kun T3-V nousi.
Tietenkin ihmiset voivat olla väsyneistä muistakin syistä, ja tätä pitääkin tutkia silloin kun se on aiheellista, mutta jos T3-V on matala muuten terveellä henkilöllä, miksi ei voitaisi korjata se ensin ja katsoa, auttaako se.
***
Väite: "Kliinisessä työssä T4-annosta voidaan kuitenkin hienosäätää potilaan oirekuvan perusteella, mutta arvojen tulisi pysyä viitealueilla."
Vastaus: Tämä väittämä on kumottu eri huolella laadituissa kokeissa, tekijöinä meidän ryhmämme ja Ito et al., kuten ylempänä on kerrottu. Pitää myös muistaa, että vain muutama vuosi sitten kilpirauhassyövän hoitosuositukset vaativat TSH:n täydellistä supressiota. Muutaman vuoden välein hoitosuosituksissa esitetään toiminnan dramaattista muutosta, ja lääkärien ja potilaiden pitäisi vain seurata perässä.
***
Väite: "Osa potilaista tuntee voivansa hyvin, kun arvot ovat lähellä ylitoiminnan rajaa (TSH lähellä viitealueen alarajaa ja T4-V-arvo lähellä viitealueen ylärajaa). Osa puolestaan pitää parempana sitä, että arvot ovat lähellä vajaatoiminnan rajaa (TSH lähellä viitealueen ylärajaa ja T4-V lähellä viitealueen alarajaa). T4-annoksien merkittävä suurentaminen ei ole kuitenkaan suositeltavaa liikatoimintaan liittyvien haittojen takia."
Vastaus: Suosituksia ei voi keskiarvoistaa, vaan ne pitää yksilöllistää. Viitealueet ovat erilaisia terveillä ja hoidetuilla, ja tämä näkyy mitattavina eroina hoidon tuloksissa, mukaan lukien T3:n kudosvaikutusten sijaismarkkereissa (Hoermann et al. 2015, Ito et al. 2017).
***
Väite: T3-monoterapia johtaa herkästi T3-tyreotoksikoosiin (TSH supprimoitu, T4-V pienentynyt ja T3-V suurentunut). T3-hoitoon liittyy suuri eteisvärinän ja siitä aiheutuvien komplikaatioiden vaara sekä osteoporoosin ja murtumien vaara.
Vastaus: Lääkärit ovat osanneet käyttää T3:a turvallisesti monen vuoden ajan, mutta he ovat räätälöineet annoksen yksilöllisesti, ja säätäneet sitä tarpeen mukaan. T3 ei siis näytä olevan ongelma, vaan hoitosuositukset, jotka yrittävät keskiarvoistaa kaikki potilaat. Tämä voi johtaa ei-toivottuihin tuloksiin, kuten voidaan odottaa erittäin yksilöllisen parametrin kohdalla. Koska on selkeästi tunnistettu ja tunnustettu kilpirauhashormonien olevan erittäin yksilöllisiä, tämä tosiasia pitäisi myös ottaa huomioon ja soveltaa hoitotilanteessa.
***
Väite: "The treatment of choice is synthetic human levothyroxine. /Synteettinen ihmisen levotyroksiini on paras hoito.
The goals for treatment are amelioration of symptoms and normalization of TSH and free T4 concentrations. /Hoidon tavoitteena on oireiden lievittäminen ja TSH:n ja T4-V:n asettuminen viitealueelle."
Vastaus: Tämä on totta, mutta se kuvaa epätodennäköistä yhdistelmää, joka on eläinkokeissa havaittu paikkansapitämättömäksi, ja tyroksiinihoidolla vaikeaksi saavuttaa (Escobar-Morreale et al. 1995, McAninch et al. 2015, Werneck de Castro et al. 2015). Kunpa T4 aina toimisi, mutta se ei toimi. Syyt käyvät ilmi säätöteknisistä periaatteista, biokemiallisista tutkimuksista, kokeellisista hoitotutkimuksista ja kliinisistä tutkimuksista.
***
5. Salmela: Aikuisten kilpirauhasen vajaatoiminnan diagnostiikka 2015
Väite: "Sentraalinen hypotyreoosi on hyvin harvinainen, ja tuore arvio sen yleisyydestä on 1 %."
Vastaus: Sekundäärinen vajaatoiminta on paljon vaikeampi diagnosoida ja todennäköisesti sen yleisyys on aliarvioitu.
***
Väite: "Kilpirauhasen kaikututkimus on yleensä tarpeeton hypotyreoosin diagnostiikassa. Se on syytä tehdä vain, jos potilaan kilpirauhanen palpaatiossa tuntuu suurentuneelta tai kyhmyiseltä."
Vastaus: Tässä ehdotetaan paluuta sadan vuoden taakse lääketieteessä. Kilpirauhasen ultraäänitutkimus on otettu lääkärien rutiinikäyttöön. Poikkeavan kuvion havaitseminen voi aiheuttaa varhaisen epäilyksen autoimmuunisairauksista, verisuonien liikakasvu on merkki liikatoiminnasta, puhumattakaan pienistä kilpirauhaskyhmyistä.
***
Väite: "Tietyille internetpalstoille on koottu kymmeniä erilaisia oireita käsittäviä luetteloita, joissa kuvattujen oireiden todetaan viittaavan hypotyreoosiin. Nämä oireet ovat kuitenkin epäspesifsiä, ja niitä voi esiintyä myös monien muiden sairauksien yhteydessä. Mainittuja oireita esiintyy erityisesti somatisaatiohäiriöissä, joiden taustalla voi olla merkittävä psykologinen trauma."
Huolella tutkittu potilashistoria on diagnoosin avain. Masentuneet ihmiset ovat usein väsyneitä aamulla herätessään, kun taas monet endokriiniset potilaat väsyvät päivän mittaan. On tärkeä opetella ja opettaa parhaiden kysymysten esittämisen taito.
***
Väite: "Kilpirauhasen vajaatoiminnan diagnoosi ei perustu oireisiin, koska mikään hypotyreoosin oireista tai kliinisistä löydöksistä ei ole riittävän sensitiivinen ja spesifinen, vaan diagnoosi tehdään laboratoriolöydösten perusteella."
Diagnostinen prosessi sisältää yhdistelmän ja todennäköisyyksien ketjun. Joskus havaitsemme sairauden laboratoriokokeen tuloksesta ja seuraamme koetulosta, toisinaan potilaan oireiden perusteella, jolloin otamme kokeet. Mutta otamme aina huomioon näiden yhdistelmän.
***
Väite: "Kliinisten tutkimusten perusteella oireiden ennustearvo lopullisessa hypotyreoosin diagnostiikassa on alle 10 %."
Vastaus: Todennäköisesti lääkärin arvo on matala, mikäli hän ei tutki oireita erittäin huolellisesti. Vakavasti ottaen tämä väite voidaan sivuuttaa tieteellisesti käyttäen Bayesin teoreemaa, joka käsittelee todennäköisyyksien yhdistelmää.
***
Väite: "Hoitoresistenttiä masennusta sairastavista jopa 50 %:lla voi olla subkliininen vajaatoiminta. Kuitenkin enemmistöllä masentuneista henkilöistä kilpirauhasen toiminta on normaalia."
Vastaus: Heillä voi olla normaalisti toimiva kilpirauhanen, mutta on tunnettu tosiasia, että masennus vaikuttaa monin tavoin kilpirauhasen toimintaan, kuten myös monet muut sairaudet. Katso osuva, uudehko katsaus (Chatzitomaris et al. 2017).
***
Väite: "Noin 20 % endokrinologeista mittauttaa myös S-T3- tai S-T3-V-pitoisuutta, mutta hyviä tutkimuksia näiden määrityksien todellisesta kliinisestä hyödystä hypotyreoosin diagnostiikassa ei kuitenkaan vielä ole. Tämän takia perusterveydenhuollossa ei ole syytä tehdä S-T3-V-määrityksiä hypotyreoosin diagnostiikassa. Hypertyreoosin diagnostiikassa ne ovat sen sijaan hyödyllisiä. Myöskään seerumin käänteis-T3 (S-rT3) määrityksiä ei ole syytä tehdä perusterveydenhuollossa. Onko S-T3-V-määrityksestä hyötyä tyroksiinihoidon seurannassa, on sekin epäselvää."
Vastaus: Tarvitaan parempi mittausmenetelmien standardointi, jotta lääkäri voisi luottaa niihin. Valmistajat pitäisi pakottaa lailla harmonisoimaan menetelmänsä, jotta mittausmenetelmät osoittaisivat todellisen pitoisuuden. Monen maan lain mukaan niiden pitää mitata tarkasti mutta ei oikein. Vaaka-analogiaa käyttäen, 70 kg näytön pitää olla vaikka 69-71 kiloa, mutta se saisi olla myös 49 - 51 tai 89 - 91 eri menetelmiä käyttäen. Suurin ongelma, joka edelleen haittaa kaikkia kilpirauhashormonien mittausmenetelmiä vuonna 2018, on riittämätön harmonisointi ja kalibrointi (Thienpont et al. 2010).
***
Väite: "Elderly people often have only a few symptoms even in clinical hypothyroidism, whereas in some young individuals tiredness and mild cognitive impairment with diffculties in new learning and selective attention and concentration can already be observed in subclinical hypothyroidism./Vanhemmilla ihmisillä on vain vähän oireita jopa kliinisessä vajaatoiminnassa, kun taas nuorilla voidaan havaita väsymystä ja lievää kognitiivista häiriöitä ja vaikeuksia uuden oppimisessa ja keskittymiskyvyssä jopa subkliinisessä vajaatoiminnassa.
The symptoms of hypothyroidism are neither sensitive nor specifc and the diagnosis of hypothyroidism is based on S-TSH and S-fT4 concentrations. /Vajaatoiminnan oireet eivät ole herkkiä eivätkä spesifisiä, ja kilpirauhasen vajaatoiminnan diagnoosi perustuu TSH:n ja T4-V:n pitoisuuksiin.
Many drugs and non-thyroidal illnesses can result in abnormal test results, and there are various analytical assay interferences such as human anti-animal antibodies in a patient’s serum, which can lead to falsely high S-TSH values. / Monet lääkkeet ja muut kuin kilpirauhasen sairaudet voivat aiheuttaa poikkeavia koetuloksia, ja eräät laboratoriomittauksia häiritsevät tekijät, kuten ihmisen eläinvasta-aineet, voivat johtaa liian korkeisiin TSH-arvoihin.
Subclinical hypothyroidism can progress to clinical hypothyroidism, especially in those with high positive values of serum TPO-ab and elevated S-TSH values. / Subkliininen vajaatoiminta voi kehittyä kliiniseksi vajaatoiminnaksi, erityisesti niillä, joilla on korkeat TPO-vasta-aineet ja kohonnut TSH."
Vastaus: Diagnostinen prosessi on ketju, joka koostuu eri todennäköisyyksistä jotka liittyvät yhteen ja joita kokenut lääkäri tulkitsee yhdistelmänä. Yllä oleva kuvaus on vieras kliinistä työtä tekevälle lääkärille. Katsomme tätä vastakkaisesta suunnasta. Lääkäri lähtee liikkeelle potilaasta, ei menetelmästä, ja yhdistää kaiken saatavilla olevan tiedon diagnostiseksi arvioksi. Sairaudesta lähtevä katsanto on avuksi vain silloin, kun me jo tiedämme, mikä sairaus on kyseessä, mutta kun olemme sitä selvittämässä, meidän täytyy kääntää katse toiseen suuntaan, kuten hyvä etsivä, joka hakee kaikki todisteet ja liittää ne yhteen.
***
Valikoituja lähteitä:
- Andersen S, Pedersen KM, Bruun NH, Laurberg P. Narrow individual variations in serum T(4) and T(3) in normal subjects: a clue to the understanding of subclinical thyroid disease. J Clin Endocrinol Metab (2002) 87:1068–1072. https://www.ncbi.nlm.nih.gov/pubmed/11889165
- Chatzitomaris A, Hoermann R, Midgley JE, Hering S, Urban A, Dietrich B, Abood A, Klein HH, Dietrich JW. Thyroid allostasis-adaptive responses of thyrotropic feedback control to conditions of strain, stress, and developmental programming. Front Endocrinol (2017) 8:163. doi:10.3389/fendo.2017.00163
- Escobar-Morreale HF, Obregón MJ, Escobar del Rey F, Morreale de Escobar G. Replacement therapy for hypothyroidism with thyroxine alone does not ensure euthyroidism in all tissues, as studied in thyroidectomized rats. J Clin Invest (1995) 96:2828–2838. doi:10.1172/JCI118353
- Gullo D, Latina A, Frasca F, Le Moli R, Pellegriti G, Vigneri R. Levothyroxine monotherapy cannot guarantee euthyroidism in all athyreotic patients. PLoS ONE (2011) 6:e22552. doi:10.1371/journal.pone.0022552
- Hoermann R, Eckl WA, Hoermann C, Larisch R. Complex relationship between free thyroxine and TSH in the regulation of thyroid function. Eur J Endocrinol (2010) 162:1123–1129. doi:10.1530/EJE-10-0106
- Hoermann R, Midgley JEM, Larisch R, Dietrich JW. Is pituitary TSH an adequate measure of thyroid hormone-controlled homoeostasis during thyroxine treatment? Eur J Endocrinol (2013) 168:271–280. doi:10.1530/EJE-12-0819
- Hoermann R, Midgley JEM, Giacobino A, Eckl WA, Wahl HG, Dietrich JW, Larisch R. Homeostatic equilibria between free thyroid hormones and pituitary thyrotropin are modulated by various influences including age, body mass index and treatment. Clin Endocrinol (Oxf) (2014) 81:907–915. doi:10.1111/cen.12527
- Hoermann R, Midgley JEM, Larisch R, Dietrich JW. Homeostatic control of the thyroid–pituitary axis: perspectives for diagnosis and treatment. Front Endocrinol (2015) 6:1–17. doi:10.3389/fendo.2015.00177
- Hoermann R, Larisch R, Dietrich JW, Midgley JEM. Derivation of a multivariate reference range for pituitary thyrotropin and thyroid hormones: diagnostic efficiency compared with conventional single-reference method. Eur J Endocrinol (2016) 174:735–743. doi:10.1530/EJE-16-0031
- Hoermann R, Midgley JEM, Larisch R, Dietrich JW. Relational stability in the expression of normality, variation, and control of thyroid function. Front Endocrinol (2016) 7:57–8. doi:10.3389/fendo.2016.00142
- Hoermann R, Midgley JEM, Larisch R, Dietrich JWC. Advances in applied homeostatic modelling of the relationship between thyrotropin and free thyroxine. PLoS ONE (2017) 12:e0187232–15. doi:10.1371/journal.pone.0187232
- Hoermann R, Midgley JEM, Dietrich JW, Larisch R. Dual control of pituitary thyroid stimulating hormone secretion by thyroxine and triiodothyronine in athyreotic patients. Ther Adv Endocrinol Metab (2017) 8:83–95. doi:10.1177/2042018817716401
- Hoermann R, Midgley JEM, Larisch R, Dietrich JW. Recent advances in thyroid hormone regulation: toward a new paradigm for optimal diagnosis and treatment. Front Endocrinol (2017) 8:57–8. doi:10.3389/fendo.2017.00364
- Ito M, Miyauchi A, Morita S, Kudo T, Nishihara E, Kihara M, Takamura Y, Ito Y, Kobayashi K, Miya A, et al. TSH-suppressive doses of levothyroxine are required to achieve preoperative native serum triiodothyronine levels in patients who have undergone total thyroidectomy. Eur J Endocrinol (2012) 167:373–378. doi:10.1530/EJE-11-1029
- Ito M, Miyauchi A, Hisakado M, Yoshioka W, Ide A, Kudo T, Nishihara E, Kihara M, Ito Y, Kobayashi K, et al. Biochemical markers reflecting thyroid function in athyreotic patients on levothyroxine monotherapy. Thyroid (2017) 27:484–490. doi:10.1089/thy.2016.0426
- Larisch R, Midgley JEM, Dietrich JW, Hoermann R. Symptomatic relief is related to serum free triiodothyronine concentrations during follow-up in levothyroxine-treated patients with differentiated thyroid cancer. Exp Clin Endocrinol Diabetes. 2018; doi: 10.1055/s-0043-125064.
- Leese GP, Soto-Pedre E, Donnelly LA. Liothyronine use in a 17 year observational population-based study - the TEARS study. Clin Endocrinol (Oxf) (2016) 85:918–925. doi:10.1111/cen.13052
- McAninch EA, Bianco AC. New insights into the variable effectiveness of levothyroxine monotherapy for hypothyroidism. Lancet Diab Endocrinol (2015) 3:756–758. doi:10.1016/S2213-8587(15)00325-3
- Midgley JEM, Larisch R, Dietrich JW, Hoermann R. Variation in the biochemical response to L-thyroxine therapy and relationship with peripheral thyroid hormone conversion. Endocr Connect (2015) 4:196-205. doi:10.1530/EC-15-0056
- Russell W, Harrison RF, Smith N, Darzy K, Shalet S, Weetman AP, Ross RJ. Free triiodothyronine has a distinct circadian rhythm that is delayed but parallels thyrotropin levels. J Clin Endocrinol Metab (2008) 93:2300–2306. doi:10.1210/jc.2007-2674
- Thienpont LM, Van Uytfanghe K, Beastall G, Faix JD, Ieiri T, Miller WG, Nelson JC, Ronin C, Ross HA, Thijssen JH, et al. Report of the IFCC Working Group for Standardization of Thyroid Function Tests; part 2: free thyroxine and free triiodothyronine. Clin Chem (2010) 56:912–920. doi:10.1373/clinchem.2009.140194
- Werneck de Castro JP, Fonseca TL, Ueta CB, McAninch EA, Abdalla SM, Wittmann G, Lechan RM, Gereben B, Bianco AC. Differences in hypothalamic type 2 deiodinase ubiquitination explain localized sensitivity to thyroxine. J Clin Invest (2015) 125:769–781. doi:10.1172/JCI77588
- Winther KH, Cramon P, Watt T, Bjorner JB, Ekholm O, Feldt-Rasmussen U, Groenvold M, Rasmussen ÅK, Hegedüs L, Bonnema SJ. Disease-specific as well as generic quality of life is widely impacted in autoimmune hypothyroidism and improves during the first six months of levothyroxine therapy. PLoS ONE (2016) 11:e0156925. doi:10.1371/journal.pone.0156925
Vastuuvapauslauseke
Nämä lyhyet vastaukset antavat vain yleisluontoista tietoa, jotta voitaisiin rohkaista tieteellistä keskustelua aiheesta. Mikäli kaivataan tarkempaa tietoa, lukija voi lukea alkuperäisiä tieteellisiä julkaisuja lähdeluettelon linkkien kautta.
Tämä teksti ei siis anna lääketieteellisiä neuvoja, eikä se ole tarkoitettu tarjoamaan erityisiä lääketieteellisiä suosituksia. Mielipiteet ja näkemykset ovat omiani, eikä ole mitään paljastettavaa eturistiriitaa.
Rudold Hoermann